
(Αυτή είναι η αγγλική έκδοση της μίνι-παρουσίασης που παρουσιάσαμε στο 10ο Πανελλήνιο Συνέδριο της Ελληνικής Ακαδημίας Νευροανοσολογίας στη Θεσσαλονίκη, Ελλάδα, που πραγματοποιήθηκε στις 14-17 Δεκεμβρίου 2024. Είναι επίσης διαθέσιμο στο LinkedIn μου: https://www.linkedin.com/pulse/how-ai-can-combat-alzheimers-emmanouil-dimarellis-ug4vf)
Στη Νευρολογία, η Τεχνητή Νοημοσύνη δεν είναι απλώς μια επιλογή—είναι ένας παράγοντας που αλλάζει τα δεδομένα. Κάθε νευροεπιστήμονας πρέπει να κατανοήσει τις δυνατότητες αυτής της τεχνολογίας για να παραμείνει μπροστά από τις εξελίξεις και να μην μείνει πίσω σε σχέση με συναδέλφους και ανταγωνιστές.
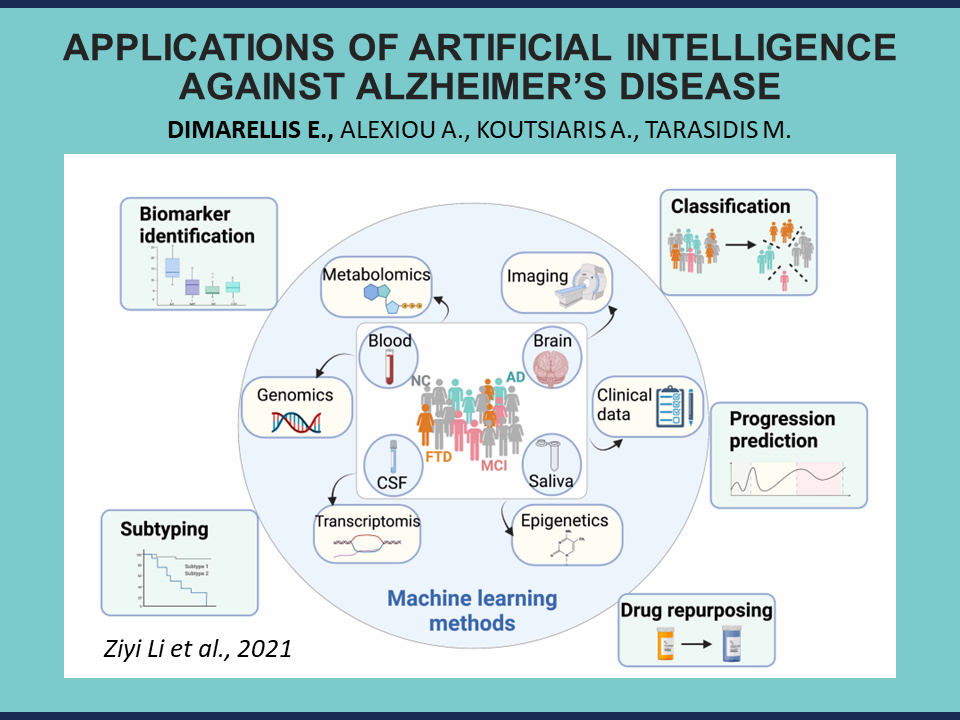
Ας ρίξουμε μια σύντομη ματιά στο τι μπορεί να προσφέρει η Τεχνητή Νοημοσύνη και πώς μπορεί να αξιοποιηθεί αποτελεσματικά στην έρευνά σας.
Όλα ξεκινούν με την κατανόηση της ασθένειας που προσπαθούμε να θεραπεύσουμε.

Η κατανόηση μιας νόσου σημαίνει ότι εμβαθύνουμε στους μηχανισμούς που οδηγούν το ανθρώπινο σώμα σε αποδυνάμωση. Σημαίνει ότι εντοπίζουμε κρίσιμους βιοδείκτες και βιοχημικές οδούς που σχετίζονται με τη νόσο, αποκαλύπτοντας νέους θεραπευτικούς στόχους ή στρατηγικές παρέμβασης. Χωρίς αυτό το θεμελιώδες βήμα, δεν μπορούμε να αναπτύξουμε πιο αποτελεσματικά διαγνωστικά και θεραπευτικά εργαλεία, ούτε να προσδιορίσουμε τις βέλτιστες πρακτικές υγειονομικής περίθαλψης.
Τεχνικές μηχανικής μάθησης, όπως η ανάλυση κύριων συνιστωσών, και μέθοδοι βιοπληροφορικής, όπως η Ανάλυση Διαφορικής Έκφρασης, χρησιμοποιούνται ευρέως για την ταυτοποίηση των πιο σημαντικών γονιδίων μεταξύ ενός τεράστιου συνόλου δεδομένων. Όπως αναφέρθηκε παραπάνω, η κατανόηση αποτελεί το πρώτο βήμα—γι’ αυτό και αυτές οι μέθοδοι εφαρμόζονται συνήθως στην αρχή κάθε ανάλυσης βιοπληροφορικής.
Έπειτα, περνάμε στις εφαρμογές της Τεχνητής Νοημοσύνης για τη διάγνωση της νόσου του Αλτσχάιμερ.

Σε αυτή τη διαφάνεια, βλέπουμε τις ροές εργασίας δύο εξαιρετικά ενδιαφερουσών αναλύσεων. Το βασικό σημείο εδώ είναι ότι η Τεχνητή Νοημοσύνη μπορεί να επεξεργαστεί δεδομένα διαφόρων τύπων, όπως επίπεδα γονιδιακής έκφρασης από ολικό αίμα και εικόνες MRI. Ένα μοντέλο Μηχανικής Μάθησης μπορεί να εντοπίσει σχέσεις μεταξύ σημείων δεδομένων και ομάδων ατόμων, τόσο λεπτές που ο ανθρώπινος εγκέφαλος θα χρειαζόταν χρόνια για να τις αποκαλύψει. Αυτή η διαδικασία πραγματοποιείται σε δύο στάδια: την εκπαίδευση και τη δοκιμή.
Στη φάση της εκπαίδευσης, τροφοδοτούμε το μοντέλο με ένα σύνολο δεδομένων (το λεγόμενο «σύνολο δεδομένων εκπαίδευσης»), το οποίο περιλαμβάνει τιμές, όπως τα επίπεδα έκφρασης συγκεκριμένων γονιδίων, καθώς και χαρακτηριστικά κάθε δείγματος (π.χ., αν προέρχεται από ασθενή ή υγιή μάρτυρα). Αρχικά, το μοντέλο κάνει προβλέψεις που είναι μάλλον τυχαίες. Ωστόσο, κάθε φορά που κάνει μια πρόβλεψη, ελέγχει αν είναι σωστή και προσαρμόζεται αναλόγως, ώστε να βελτιώνει τη μελλοντική του ακρίβεια. Εάν το μοντέλο είναι καλά σχεδιασμένο και έχει εκπαιδευτεί σε επαρκή δεδομένα, στο τέλος της εκπαίδευσης θα μπορεί να κάνει ακριβείς προβλέψεις.
Στη φάση της δοκιμής, αξιολογούμε την ακρίβεια του μοντέλου. Αυτό γίνεται τροφοδοτώντας το με ένα νέο, άγνωστο σύνολο δεδομένων («σύνολο δεδομένων δοκιμής»), χωρίς να του επιτρέπεται περαιτέρω προσαρμογή. Η διαδικασία αυτή μας δίνει μετρήσεις που δείχνουν την απόδοση του μοντέλου. Αν τα αποτελέσματα είναι ικανοποιητικά, το μοντέλο μπορεί να εφαρμοστεί σε πραγματικά προβλήματα, όπως η διάγνωση της νόσου του Αλτσχάιμερ, ενδεχομένως αποφεύγοντας επεμβατικές διαδικασίες, όπως η οσφυονωτιαία παρακέντηση.
Στη συνέχεια, εξετάζουμε τις εφαρμογές της Τεχνητής Νοημοσύνης στην πρόγνωση της νόσου του Αλτσχάιμερ.

Η διαφορά μεταξύ διάγνωσης και πρόγνωσης είναι ότι η πρόγνωση χρησιμοποιείται για να προβλέψει εάν ένα νεότερο άτομο χωρίς συμπτώματα θα αναπτύξει μια ασθένεια στο μέλλον. Είναι διαφορετικό από τη διάγνωση κάποιου που έχει ήδη την ασθένεια. Ελπίζουμε να κάνουμε ξεκάθαρη αυτή τη διαφορά με τις εικόνες στη διαφάνεια.
Όπως μπορείτε να δείτε (εντάξει, ζουμ λίγο :’D), ο Sam ο γιατρός και ο Nick το άτομο είναι νέοι στην πρώτη φωτογραφία, αλλά μεγαλώνουν στην 3η και 4η φωτογραφία. Ο Sam συνέλεξε δείγματα αίματος από τον Nick δύο διαφορετικές φορές (ή και περισσότερες) και ανέλυσε τα δείγματα αίματος που συνέλεξε κατά μήκος. Το έκανε επειδή ήθελε να ελέγξει πώς άλλαξαν οι εκφράσεις των γονιδίων με την πάροδο του χρόνου. Φυσικά, ο Νικ δεν ήταν το μόνο άτομο που έδωσε δείγματα. Πολλά άτομα όπως ο Nick έδωσαν δείγματα και ο Sam κατάφερε να εντοπίσει αλλαγές βασικής γονιδιακής έκφρασης με την πάροδο του χρόνου που ήταν στατιστικά και σημαντικά διαφορετικές μεταξύ εκείνων που τελικά ανέπτυξαν τη νόσο και εκείνων που δεν είχαν.
Μέχρι σήμερα, τα μοντέλα που προσεγγίζουν αυτό το σχήμα είναι εν μέρει μόνο προγνωστικά, γιατί βασίζονται σε νευροπαθολογικά ευρήματα από διαμήκεις μαγνητικές τομογραφίες και εστιάζουν περισσότερο στην έγκαιρη διάγνωση παρά στην πρόγνωση. Η έγκαιρη διάγνωση σημαίνει ότι το άτομο έχει ήδη παρουσιάσει παθοφυσιολογικές αλλαγές αλλά δεν είχε τα κλινικά συμπτώματα της νόσου. Αυτή η ταξινόμηση είναι σημαντική γιατί όταν έχουν συμβεί αυτές οι παθοφυσιολογικές αλλαγές, μπορεί να μην είναι δυνατή η μετατροπή της κατάστασης, ενώ η πρόγνωση επιτρέπει την έγκαιρη θεραπεία που θα μπορούσε να αποτρέψει την ανάπτυξη της νόσου συνολικά. Η πρωτοβουλία UK BioBank φιλοδοξεί να παράγει τα δεδομένα που απαιτούνται για πραγματικές προγνωστικές προσεγγίσεις.
Στη συνέχεια, έχουμε εφαρμογές τεχνητής νοημοσύνης για επαναχρησιμοποίηση φαρμάκων για AD.

Μια διαφάνεια και μερικές παράγραφοι δεν μπορούν να αποτυπώσουν τον ενθουσιασμό μας για αυτήν την εφαρμογή της Τεχνητής Νοημοσύνης!
Πολλά φάρμακα έχουν ήδη περάσει την πρώτη κλινική δοκιμή και θεωρούνται ασφαλή, αλλά η θεραπευτική τους δυνατότητα παραμένει άγνωστη. Ορισμένα από αυτά αναπτύχθηκαν για συγκεκριμένες ασθένειες, αλλά δεν πέτυχαν τα επιθυμητά αποτελέσματα. Ωστόσο, το γεγονός ότι ένα φάρμακο δεν έχει δράσει για μία ασθένεια δεν σημαίνει ότι δεν μπορεί να είναι αποτελεσματικό για κάποια άλλη ή ότι δεν μπορεί να αποδώσει όταν συνδυαστεί με τα κατάλληλα φάρμακα.
Έτσι, υπάρχουν πολλά ασφαλή φάρμακα που δεν χρησιμοποιούνται, απλώς επειδή δεν γνωρίζουμε πώς και σε ποια ασθένεια να τα εφαρμόσουμε. Ο αριθμός των πιθανών συνδυασμών φαρμάκων είναι τεράστιος, καθιστώντας αδύνατο τον έλεγχό τους έναν προς έναν. Εδώ είναι που η Τεχνητή Νοημοσύνη γίνεται εξαιρετικά χρήσιμη. Μπορεί να αναλύσει μεγάλα σύνολα δεδομένων και να εντοπίσει ποια φάρμακα μοιάζουν με εκείνα που ήδη χρησιμοποιούνται για μια ασθένεια, επιταχύνοντας έτσι τη διαδικασία επιλογής και επιτρέποντάς μας να ξεκινήσουμε in vitro και in vivo πειράματα στα πιο υποσχόμενα φάρμακα.
Αυτή η προσέγγιση είναι πολύτιμη για δύο βασικούς λόγους:
(α) Κόστος – Εστιάζοντας μόνο στα πιο πιθανά φάρμακα, εξοικονομούμε τεράστιους πόρους.
(β) Χρόνος – Η ανακάλυψη νέων θεραπευτικών επιλογών γίνεται γρηγορότερα, επιταχύνοντας τη μετάβαση από το εργαστήριο στην κλινική πράξη.
Επιπλέον, αν λάβουμε υπόψη ότι αυτά τα φάρμακα έχουν ήδη ελεγχθεί για την ασφάλειά τους, το όφελος αυτής της διαδικασίας είναι ανεκτίμητο!
Σας προτείνουμε να διαβάσετε την πλήρη μελέτη του Chenglong X. et al., 2022, η οποία παρουσιάζει μια ολοκληρωμένη ερευνητική προσέγγιση, συνδυάζοντας ανάλυση in silico και εργαστηριακά πειράματα.
Τέλος, ας δούμε πώς η Τεχνητή Νοημοσύνη μπορεί να συμβάλει στην επιλογή πειραματικών μοντέλων.

Για αυτήν την εφαρμογή, δεν μπορούμε ακόμη να δώσουμε ένα συγκεκριμένο παράδειγμα που να αφορά τη νόσο του Αλτσχάιμερ, καθώς αυτή η ιδέα βρίσκεται σε πρώιμο στάδιο ανάπτυξης. Το ιδανικό σενάριο θα ήταν να έχουμε έναν προσομοιωτή υπολογιστή, όπου θα μπορούσαμε να εισάγουμε το φάρμακο και το πειραματικό μοντέλο (π.χ. κύτταρα HeLa) και να παρακολουθήσουμε τα προσομοιωμένα αποτελέσματα. Αν τα αποτελέσματα ήταν θετικά, τότε θα άξιζε να προχωρήσουμε σε περαιτέρω πειραματισμούς. Αντίθετα, αν ήταν αρνητικά, θα αποφεύγαμε σπατάλη πόρων σε μια μη υποσχόμενη προσέγγιση.
Τα καλά νέα είναι ότι αυτή η ιδέα έχει αρχίσει να υλοποιείται, τουλάχιστον στον τομέα της τοξικολογίας. Η πρωτοβουλία RASAR βοηθά στον γρήγορο εντοπισμό της τοξικότητας ενός φαρμάκου για ένα συγκεκριμένο μοντέλο, επιτρέποντας έτσι την αποφυγή περιττών εξόδων σε λάθος πειράματα. Ωστόσο, μια πιο εκτεταμένη προσομοίωση, όπως αυτή που φιλοδοξεί να επιτύχει η πρωτοβουλία IMPROVER, δεν είναι ακόμη διαθέσιμη λόγω έλλειψης επαρκών δεδομένων.
Αυτό ήταν το τελευταίο σημείο για σήμερα. Σας ευχαριστούμε για την προσοχή σας!
Πηγές
Aksu, Y., Miller, D. J., Kesidis, G., Bigler, D. C., & Yang, Q. X. (2011). An MRI-Derived definition of MCI-To-AD conversion for Long-Term, automatic prognosis of MCI patients. PLoS ONE, 6(10). https://doi.org/10.1371/journal.pone.0025074
Kononikhin, A. S., Zakharova, N. v., Semenov, S. D., Bugrova, A. E., Brzhozovskiy, A. G., Indeykina, M. I., Fedorova, Y. B., Kolykhalov, I. v., Strelnikova, P. A., Ikonnikova, A. Y., Gryadunov, D. A., Gavrilova, S. I., & Nikolaev, E. N. (2022). Prognosis of Alzheimer’s Disease Using Quantitative Mass Spectrometry of Human Blood Plasma Proteins and Machine Learning. International Journal of Molecular Sciences, 23(14). https://doi.org/10.3390/ijms23147907
Li, Ziyi, Jiang, X., Wang, Y., & Kim, Y. (2021). Applied machine learning in Alzheimer’s disease research: Omics, imaging, and clinical data. In Emerging Topics in Life Sciences (Vol. 5, Issue 6, pp. 765–777). Portland Press Ltd. https://doi.org/10.1042/ETLS20210249
Luechtefeld, T., Marsh, D., Rowlands, C., & Hartung, T. (2018). Machine learning of toxicological big data enables read-across structure activity relationships (RASAR) outperforming animal test reproducibility. Toxicological Sciences, 165(1), 198–212. https://doi.org/10.1093/toxsci/kfy152
Marzi, S. J., Schilder, B. M., Nott, A., Frigerio, C. S., Willaime-Morawek, S., Bucholc, M., Hanger, D. P., James, C., Lewis, P. A., Lourida, I., Noble, W., Rodriguez-Algarra, F., Sharif, J. A., Tsalenchuk, M., Winchester, L. M., Yaman, Ü., Yao, Z., Ranson, J. M., & Llewellyn, D. J. (2023). Artificial intelligence for neurodegenerative experimental models. In Alzheimer’s and Dementia. John Wiley and Sons Inc. https://doi.org/10.1002/alz.13479
Montana, G., & Payan, A. (2015). Predicting Alzheimer’s disease: a neuroimaging study with 3D convolutional neural networks. http://adni.loni.usc.edu/wp-content/uploads/how
Nanni, L., Interlenghi, M., Brahnam, S., Salvatore, C., Papa, S., Nemni, R., & Castiglioni, I. (2020). Comparison of Transfer Learning and Conventional Machine Learning Applied to Structural Brain MRI for the Early Diagnosis and Prognosis of Alzheimer’s Disease. Frontiers in Neurology, 11. https://doi.org/10.3389/fneur.2020.576194
Xie, C., Zhuang, X. X., Niu, Z., Ai, R., Lautrup, S., Zheng, S., Jiang, Y., Han, R., Gupta, T. sen, Cao, S., Lagartos-Donate, M. J., Cai, C. Z., Xie, L. M., Caponio, D., Wang, W. W., Schmauck-Medina, T., Zhang, J., Wang, H. ling, Lou, G., … Fang, E. F. (2022). Amelioration of Alzheimer’s disease pathology by mitophagy inducers identified via machine learning and a cross-species workflow. Nature Biomedical Engineering, 6(1), 76–93. https://doi.org/10.1038/s41551-021-00819-5
Zhang, Y., Miao, Y., Tan, J., Chen, F., Lei, P., & Zhang, Q. (2023). Identification of mitochondrial related signature associated with immune microenvironment in Alzheimer’s disease. Journal of Translational Medicine, 21(1). https://doi.org/10.1186/s12967-023-04254-9
~~~~~ Για εσένα, εξονυχιστικέ ερευνητή, ένα μικρό μυστικό: Η Τεχνητή Νοημοσύνη μπορεί να σε βοηθήσει να δημιουργήσεις απίστευτες εικόνες για τις διαφάνειές σου, όπως ακριβώς έκανα κι εγώ, για να ενισχύσεις την παρουσίασή σου! 😉 ~~~~~

Αφήστε μια απάντηση